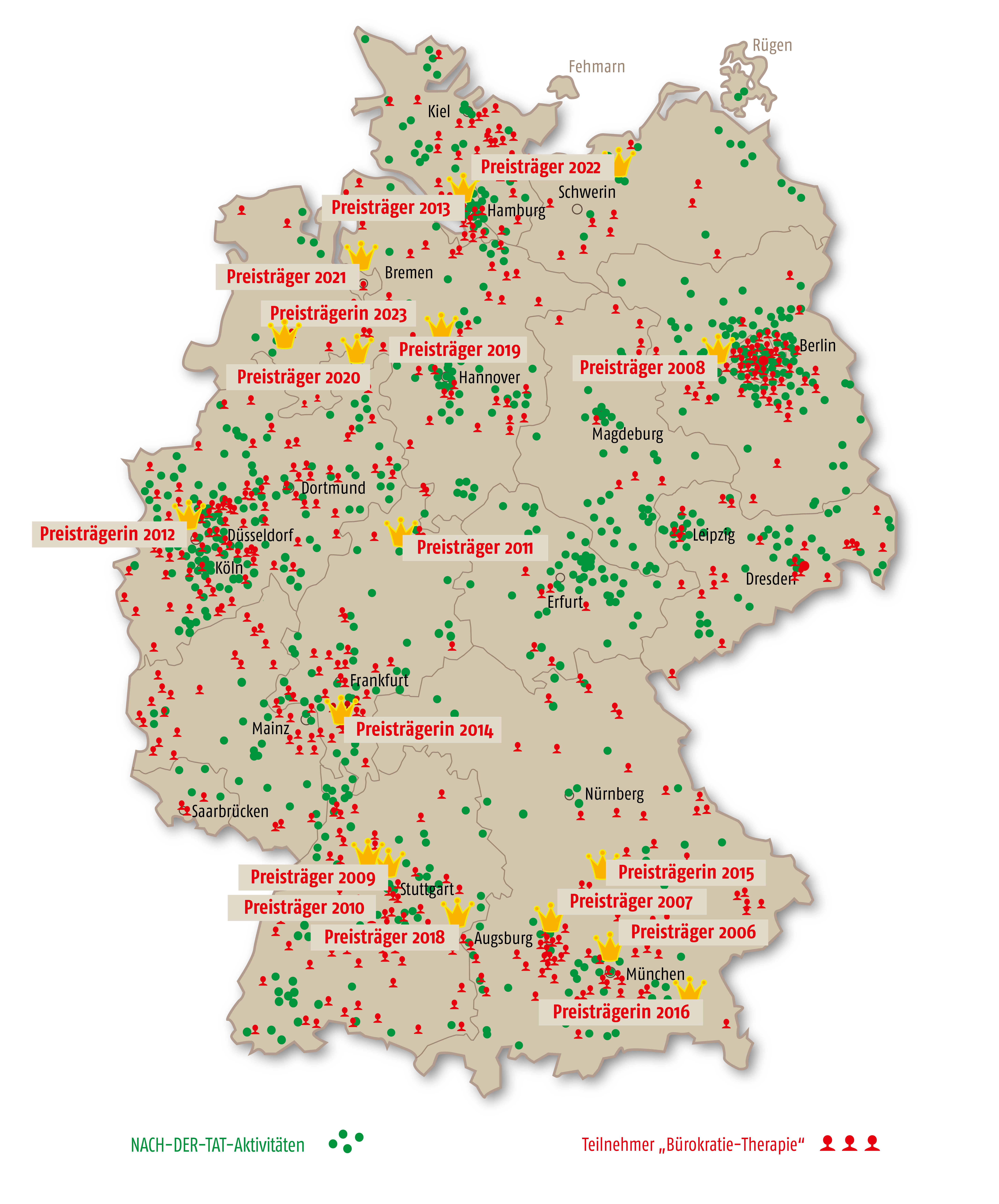
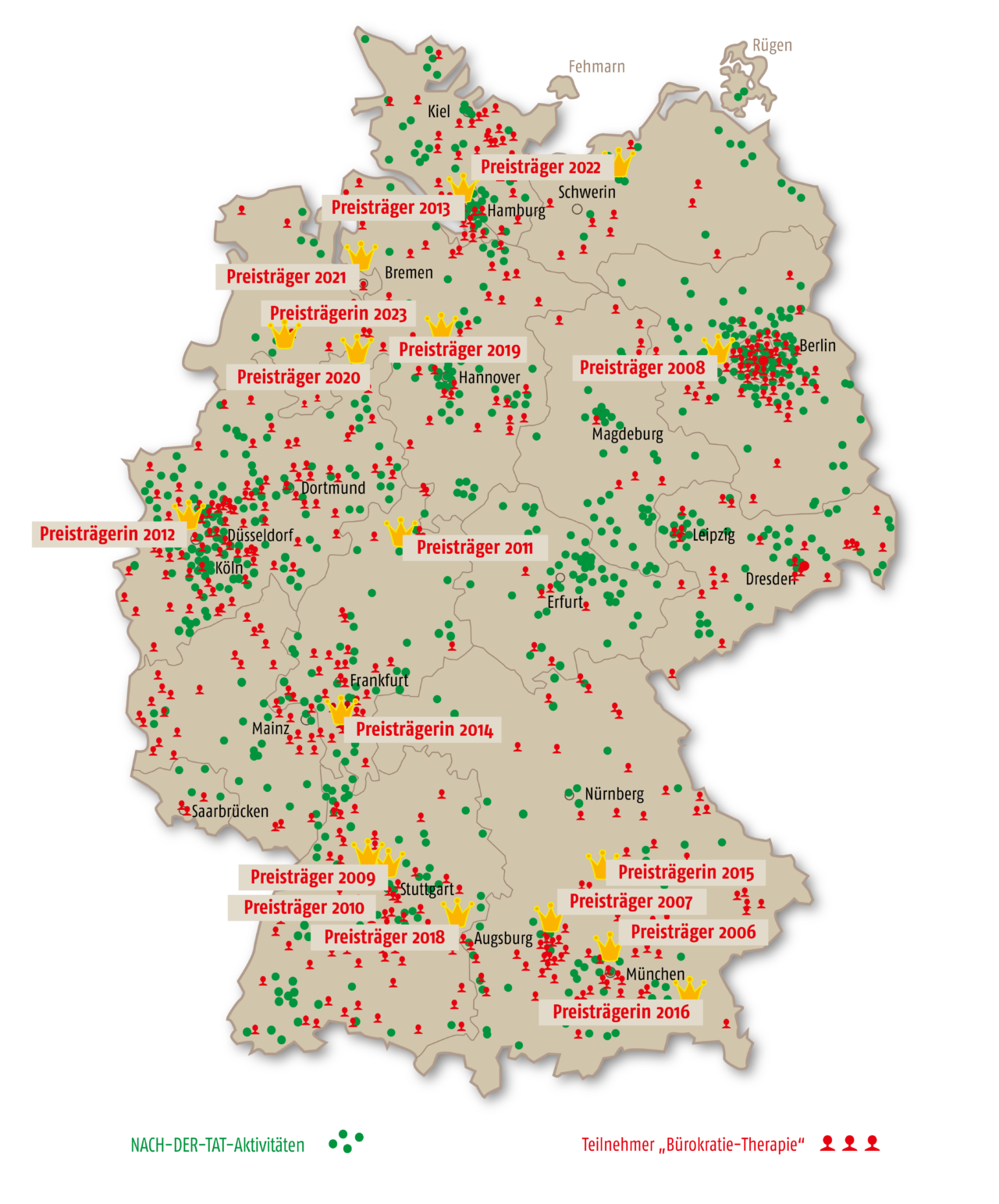
Die Werner Bonhoff Stiftung ist eine gemeinnützige und unabhängige Stiftung mit Sitz in Berlin.
Sie wirkt durch ihre zwei bundesweiten, operativen Projekte.

Die beste Schülerzeitung beim Sonderpreis „Hat Deine Schule Mobbing im Griff?“ 2024:
die Schülerzeitung „ES-Magazin“ der Eichenschule Scheeßel aus Nidersachsen.
Herzlichen Glückwunsch!
Wir freuen uns die Redaktion bei der Preisverleihung im Bundesrat im Juni 2024 auch persönlich kennenzulernen.

Einmalige Bürokratismus-Ausstellung im Rathaus der Stadt Verl

„Hat Deine Schule Mobbing im Griff?“ – Schülerzeitung aus dem brandenburgischen Groß Köris gewinnt Sonderpreis

Neu in unserer Fallsammlung: Muss ein bestehender Milchbetrieb einen Reiterhof weichen? Das Grundstücksverkehrs-gesetz in der Praxis

Beitrag beim ARD-Magazin „plusminus“ – Weniger Bürokratie? Ja, aber…
© 2024, Werner Bonhoff Stiftung. Alle Rechte vorbehalten.